
德国柏林当地时间2024年1月11日,博安生物自主研发的地舒单抗注射液(BA6101和BA11021)的“国际Ⅲ期临床完成入组暨Ⅰ期试验结果发布会”顺利召开。该Ⅰ期临床试验的主要研究者Parexel International GmbH的Rainard Fuhr博士、博安生物研发总裁兼首席运营官窦昌林博士、博安生物首席医学官周明博士与参与该项试验的核心成员汇聚一堂,共同探讨Ⅰ期临床研究结果及本品在国际市场的应用前景,以加速推进BA6101和BA1102的国际开发进程。

窦昌林博士(前排左起第5位)、周明博士(前排左起第4位)与研究者团队
BA6101和BA1102分别为地舒单抗原研药Prolia®和Xgeva®的生物类似药。Prolia®在全球范围内广泛应用于骨质疏松症,而Xgeva®则在全球用于实体肿瘤骨转移和多发性骨髓瘤、骨巨细胞瘤、高钙血症的治疗。
2022年11月,首个国产地舒单抗注射液BA6101(博优倍®)在中国率先上市,在临床应用中获得医生与患者的积极反馈。2023年3月,BA1102的上市许可申请获得国家药品监督管理局受理,即将获批上市。
博安生物在中国获得地舒单抗首发优势的同时,也积极同步推进其国际临床和国际注册,2020年Ⅰ期临床试验分别在美国和欧洲获得批准,在欧洲进行的Ⅰ期临床试验(药代动力学比对试验)已经完成,于本次会议首次公布;2022年Ⅲ期临床试验(有效性比对研究)分别在欧美日获得批准,目前已经完成全部受试者入组。
在此次柏林会议上,Ⅰ期试验的主要研究者Rainard Fuhr博士与博安生物团队详细交流了临床数据及结果。该项临床试验为一项随机、双盲、三臂、欧洲和美国来源的Prolia®对照的单次给药比对研究。研究结果显示:BA6101、欧盟Prolia®和美国Prolia® 3组两两之间分别在药代动力学和药效动力学达到生物等效,安全性和免疫原性相似。
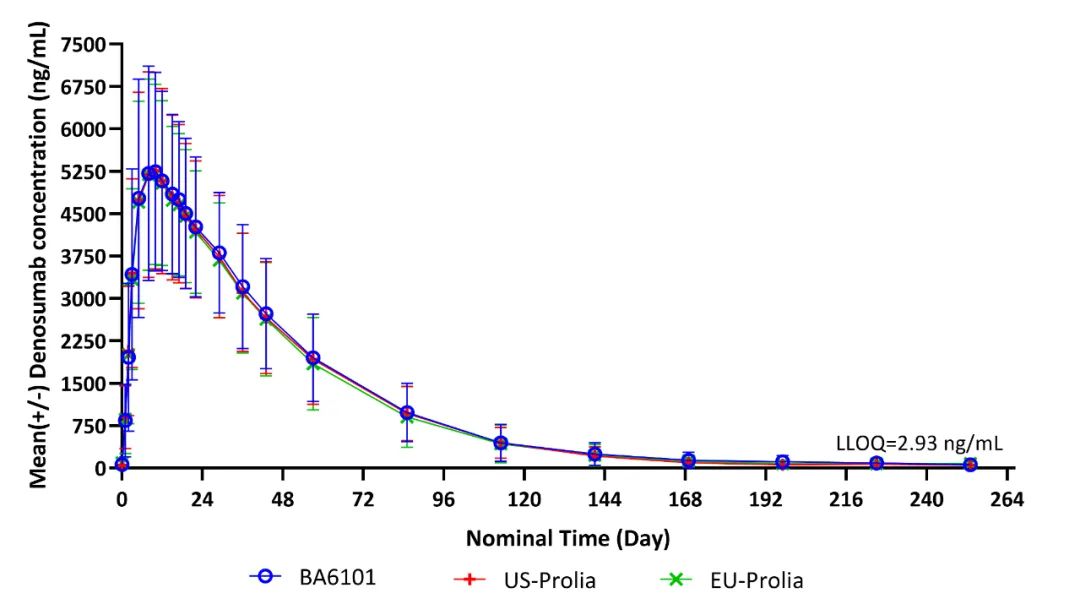
博安生物地舒单抗国际I期临床试验血药浓度-时间曲线图
Rainard Fuhr博士在会上表示:“地舒单抗在全球范围内得到广泛应用,并在相关治疗领域中持续发挥出重要作用。生物类似药的研发是满足患者临床需求的重要途径。我们很高兴地看到博安生物地舒单抗的临床数据,显示其国际临床试验的高质量推进。我们期待这两款产品的尽快上市,为患者提供优质治疗选择,提升相关治疗领域的用药可及性。”
当前进行的地舒单抗国际多中心有效性安全性比对临床(Ⅲ期)试验,在欧洲、美国、日本三地同步展开。该试验为一项随机、双盲、平行、原研参照药对照的国际多中心临床研究,比较博安生物的地舒单抗注射液与原研参照药Prolia®的有效性、安全性、药代动力学及免疫原性。根据美国食品药品监督管理局(FDA)发布的行业指南《证明与参照药生物相似性方面的科学考虑》2、欧洲药品监督管理局(EMA)发布的《生物类似药指南》3、日本医药品医疗器械综合机构(PMDA)发布的《生物类似药的质量、安全性和有效性保证指南》4以及博安生物与FDA、EMA和PMDA的沟通交流意见,在完成国际多中心比对临床试验后BA6101和BA1102可分别向FDA、EMA和PMDA提交上市申请,申请原研参照药的全部适应症。
博安生物研发总裁兼首席运营官窦昌林博士表示:“公开数据显示Prolia®和Xgeva®在2022年的全球销售额分别达到36.3亿美元和20.1亿美元,可以预见地舒单抗生物类似药也将具有广阔的国际市场前景。我们将在严格遵循国际GCP标准完成国际多中心Ⅲ期临床试验的同时,继续加强全面符合欧美日要求的cGMP体系建设,为顺利申报上述国家和地区的上市许可申请做好准备。”
1. 备注:博安生物地舒单抗BA6101和BA1102的曾用产品代号分别为LY06006和LY01011
2. FDA. Scientific Considerations in Demonstrating Biosimilarity to a Reference Product. April 2015
3. EMA. Guideline on similar biological medicinal products. CHMP/437/04 Rev 1. 2015
4. PMDA. Guideline for the quality, safety, and efficacy assurance of follow-on biologics. 2009
