
近日,由博安生物自主开发的纳武利尤单抗注射液(BA1104,曾用项目号:LY01015)的I期临床药代动力学比对研究结果在国际期刊《BioDrugs》上发表,为全球首个披露Ⅰ期临床药代相似性结果的欧狄沃®(Opdivo®)的生物类似药。

https://doi.org/10.1007/s40259-024-00679-w
纳武利尤单抗是一种针对细胞表面程序性死亡-1(PD-1)受体的人源化单克隆免疫球蛋白IgG4抗体,通过解除肿瘤细胞对免疫细胞的免疫抑制,恢复机体免疫应答,发挥抗肿瘤作用,并延长患者生命周期。以其为代表的肿瘤免疫疗法已成为全球范围内肿瘤治疗的主要手段之一,持续呈现出广阔的临床应用价值。
该Ⅰ期临床研究为在中国男性健康受试者中比较BA1104和欧狄沃®的药代动力学特征、安全性、耐受性和免疫原性的随机、双盲、单次给药、平行对照的研究。共有176例受试者以1:1的比例随机接受0.3mg/kg BA1104或欧狄沃®单次静脉输液。该研究中药代动力学的主要评价指标为AUC0-∞,次要评价指标为AUC0-t和Cmax,此外还有安全性评价和免疫原性评价指标。
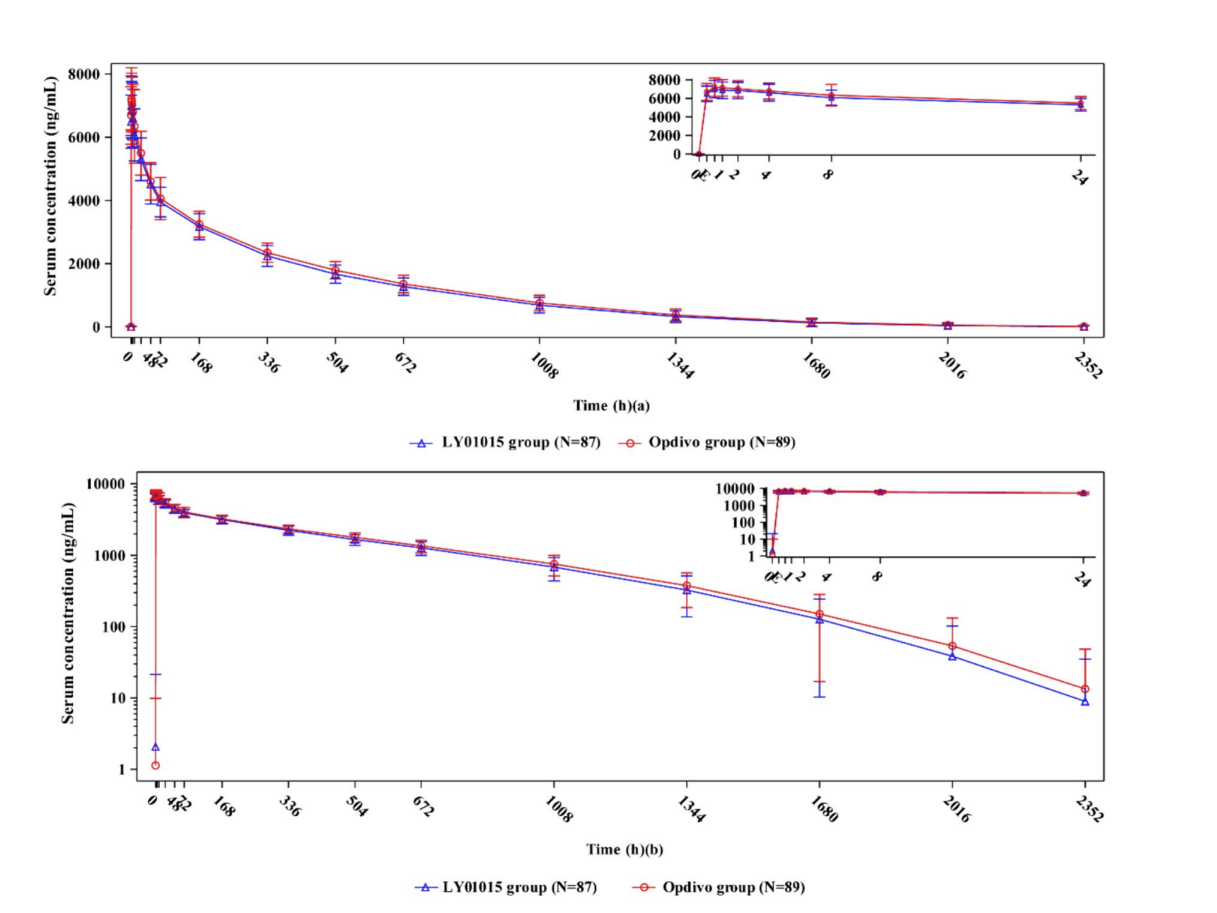
图:平均血清浓度-时间线性图(a)和半对数图(b)。LY01015组(蓝线)和Opdivo®组(红线)。数据以平均值±标准差的形式呈现。E表示输液立即结束。
博安生物研发总裁兼首席运营官窦昌林博士表示:“基于博安生物自主知识产权的创新药发现平台,博安生物开发了一系列肿瘤治疗药物,全面布局‘肿瘤免疫+ADC’产品组合,将探索BA1104与公司其它在研肿瘤创新药的联合治疗潜力,包括CD25、CEA/CD3、Claudin 18.2、CD228等靶点,以改善现有标准疗法的治疗效果。”
BA1104的开发进度处于国际领先,为全球首个启动III期临床试验的欧狄沃®的生物类似药。目前III期临床研究正在有序进行,该研究为一项随机、双盲、多中心试验,旨在比较BA1104与欧狄沃®分别联合化疗药物治疗晚期复发性或转移性食管鳞癌患者的有效性、安全性和免疫原性。根据中、美、欧药品监管机构的生物类似药相关指南,BA1104在完成III期临床试验后可申请同时获批欧狄沃®的全部适应症,包括非小细胞肺癌、头颈部鳞状细胞癌、胃或胃食管连接部腺癌、恶性胸膜间皮瘤和尿路上皮癌等十余种肿瘤。BA1104的早日上市将有助于解决未满足的临床需求,可显著提高患者用药可及性。
